La esclerosis lateral amiotrófica (ELA) y la demencia frontotemporal (DFT) son enfermedades neurodegenerativas que, en un porcentaje de casos (15%), se presentan combinadas, y que tienen muchos rasgos moleculares e histológicos en común. Al igual que ocurre en otras enfermedades neurodegenerativas, existen familias con muchos miembros afectados, y en estos casos se habla de ELA o DFT genética o familiar (10% de los casos). Se conocen varios genes relacionados con estas enfermedades familares: SOD1, TARDBP, FUS, UBQLN2, PFN1, OPTN, VCP, MATR3, TUBA4A y C9ORF72. Sin embargo, en un tercio de los casos familiares no se conoce el gen responsable, y tampoco se conoce con detalle el proceso molecular que da lugar a las enfermedades esporádicas (no familiares). Como ha venido ocurriendo en la investigación de la enfermedad de Alzheimer o la enfermedad de Parkinson, cada nuevo descubrimiento genético proporciona información fundamental para entender el origen de los casos no genéticos, que son los más frecuentes.
En este estudio publicado en la revista Nature Communications, y dirigido por investigadores de la Macquairie University, de Sidney, Australia, se ha demostrado la existencia de un nuevo gen implicado en la ELA y la DFT familiar. Los investigadores estudiaron, mediante análisis genéticos de última generación, una extensa familia australiana que incluía 10 miembros con ELA y/o DFT, con un patron de herencia autosómico dominante, y que no presentaba mutaciones en los genes patogénicos conocidos. Se encontró una asociación (linkage) de la enfermedad a un lugar (locus) en el cromosoma 16 (16p13.3), que corresponde al gen CCNF, y se identificó la mutación asociada. A continuación, se examinó un gran número de familias con ELA y/o DFT de Australia, Reino Unido, Canadá, Italia, Japón, España e Irlanda, y se identificaron cinco nuevas mutaciones en el gen CCNF. Además, en casos esporádicos (no familiares) de estos países se identificaron 19 variantes del gen CCNF que modifican la estructura de la proteína. Estas variantes son más frecuentes entre los pacientes con ELA que en la población general.
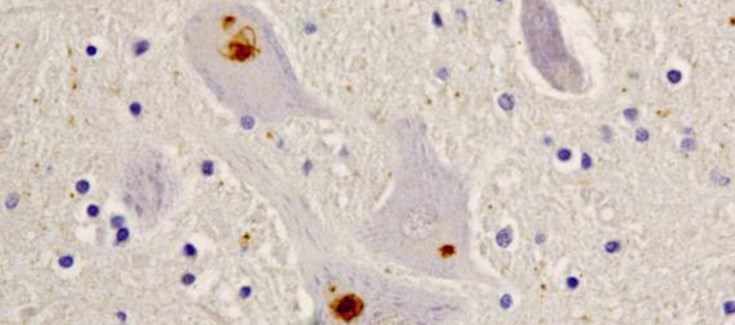
El gen CCNF (también llamado FBX01) codifica la ciclina F, una proteína de la familia de las ciclinas. La ciclina F participa en la formación del complejo E3 ubiquitina – proteína ligasa, que a su vez forma parte del sistema ubiquitina proteasoma (SUP). La integridad de las funciones celulares depende del mantenimiento o integridad (homeostasis) de las proteínas (proteostasis), lo que implica la eliminación de las proteínas mal plegadas a través del SUP y del sistema autofágico – lisosomal (por el descubrimiento de este ultimo sistema se le concedió el premio Nobel de Medicina y Fisiología de 2016 a su descubridor, Yoshinori Ohsumi). En un modelo celular, los investigadores demostraron que las variantes de ciclina F asociadas a ELA/DFT daban lugar a la acumulación de proteínas ubiquitinadas (unidas a ubiquitina) y a la disfunción del SUP. También observaron un aumento de proteína TDP-43 ubiquitinada (un marcador molecular de la mayoria de los casos de ELA/DFT) en neuronas portadoras de la mutación de CCNF.
Los estudios reunidos en esta publicación ponen de manifiesto el papel de un nuevo gen y de una nueva proteína en la patogenia de la ELA y la DFT, tanto familiar como esporádica, lo que amplía el campo para la investigación de nuevos abordajes terapéuticos para estas enfermedades.
Uno de los casos estudiados con la nueva mutación corresponde a una paciente de ELA que donó su tejido cerebral y la médula espinal al Banco de Tejidos CIEN. En el estudio también participaron investigadores del Hospital Gregorio Marañón y Doce de Octubre, de Madrid, y del Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER), del Instituto de Salud Carlos III.
Ver publicación original